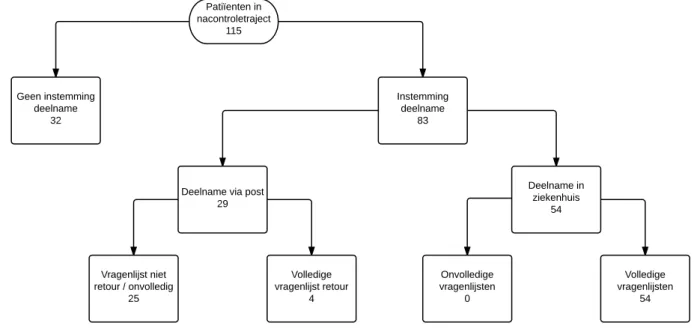
Essay #69161
Full text
Figure



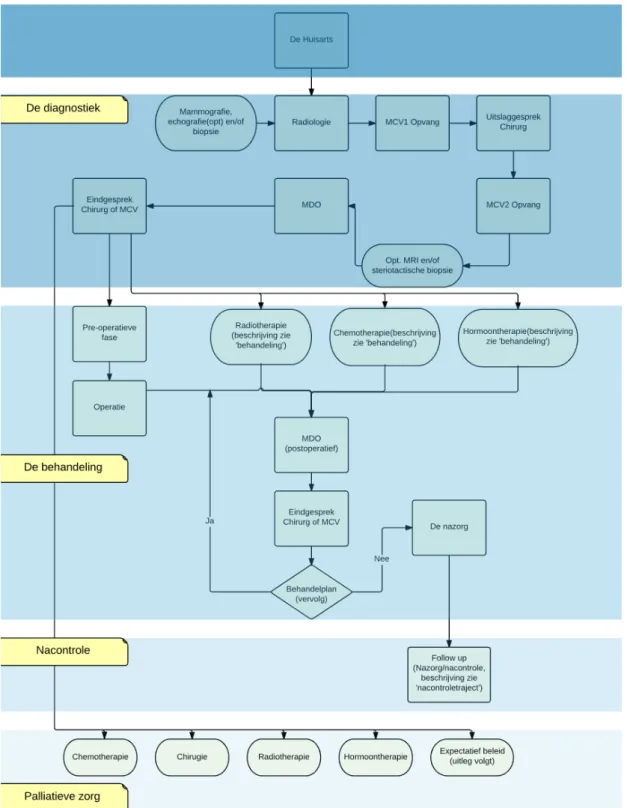
Related documents
Intraoperative antegrade colonic lavage is a simple and safe procedure facilitating a primary anastomosis, without the need for a covering colostomy in left-sided
The total amount of iron assimilated by the fetus is approximately 300 mg in human pregnancy, by a process of placental transfer thought to involve active transport (Pribilla et
We hypothesized that in FA patients, who are commonly in- fected with HPVs and who frequently develop squamous cell car- cinomas of the (female) reproductive tract and the head/neck
Objective of this study was to identify factors associated with antepartum haemorrhage, and to quantitate maternal morbidity, mortality and perinatal outcome in patients
In this study, we devel - oped a rapid multiplex qPCR (M-qPCR) assay for identification of MTB, which was confirmed sensitive and specific for FFPE sample in conventional
Abstract: Objective: To verify whether miR-630 could inhibit Triple-negative Breast Cancer (TNBC) cell line MDA- MB-231 cells migration and invasion by targeting SOX4 in
MTT assay, cell counting assay and invasion assay were used to assess the effects of miR-27b upregulation or downregulation on the proliferation and invasion of HNSC cells.. The
investigate the function of WWP1 in osteosar- coma, two cell lines, MG63 and HOS, which showed higher WWP1 mRNA and protein level, were transiently transfected with siRNA against