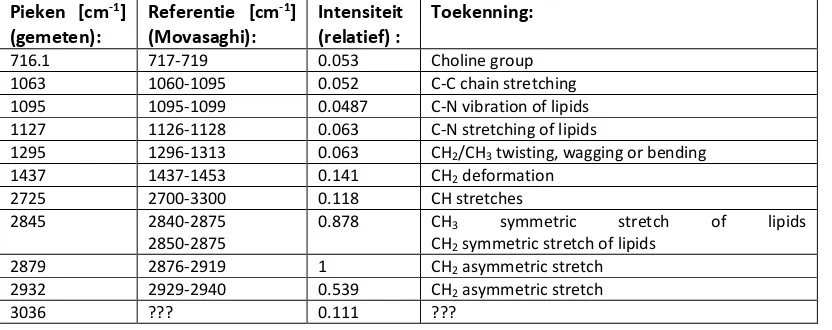
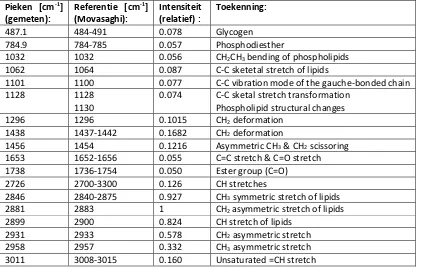
Raman analyse van lipide in cellen
Full text
Figure



Related documents
The American Medico-Psychological Association created the requested committee in 1913 and the first classification system, produced in collaboration with the National
The observation of object Q0256-m9 led to a serendipitous discovery of a companion galaxy with an identical redshift (separated by 3 00. 087), was included on this mask, and its
Uncertainties on the fitted parameters were obtained through 5,000 Monte Carlo simula- tions where the observed flux values were modified by Gaus- sian noise and the width of
[3] Hence this study was performed to evaluate the preliminary biochemical and pharmacological aspects (Anti histaminic, analgesic, Acute and Chronic anti
Conclusions: IL-10-producing B cells are increased in CVB3-induced AVMC, indicating that IL-10-producing B cells may play an important role in the pathogenesis of CVB3-induced
QUALITY VERIFICATION OF SIX MEDICINES IN WHOLES AND HALVES TABLETS, RE-PACKAGED IN INDIVIDUAL PLASTIC.. COMPARTMENTS DURING
Cell lysates were assayed for luciferase activ- ity and β-galactosidase activity using a Secrete- PairTMDual Luminescence Assay kit (Gene Figure 4. P120ctn inhibited
There are only four reported cases of localized form of tenosynovi- al giant cell tumor or pigmented villonodular synovitis arising from posterior cruciate liga- ment (PCL)